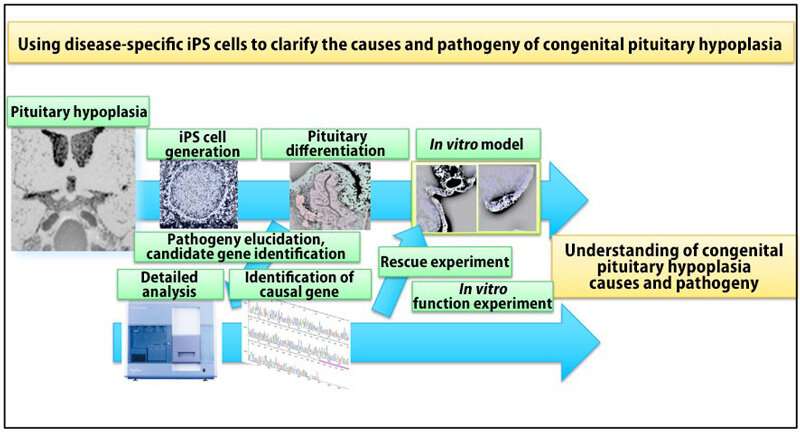
Forscher an der Universität Kobe Graduate School of Medicine entwickelt haben, die weltweit erste angeborene Hypoplasie der Hypophyse (CPH) – Modell mit Patienten-abgeleiteten iPS-Zellen. Die Forschungsgruppe, bestehend aus Associate Professor Yutaka TAKAHASHI, medizinische Forscher Matsumoto Ryusaku und Professor Takashi Aoi et al. gelungen, mit dem Modell zu beleuchten, die zugrunde liegenden Mechanismen CPH. Das team hat versucht, eine Anwendung dieses Modells auf andere Hypophysen-Erkrankungen und drug discovery.
Die Ergebnisse dieser Studie wurden veröffentlicht in der amerikanischen wissenschaftlichen Zeitschrift, die J Klinische Untersuchung am Dezember 17, 2019.
Wissenschaftlicher Hintergrund
Hypophyseninsuffizienz verursacht durch CPH ist nicht ungewöhnlich, und es ist manchmal Lebens-threating. Patienten mit dieser Erkrankung erfordern lebenslange Hormon-Ersatz-Therapie. Die Ursachen und zugrunde liegenden Mechanismen sind nicht gut verstanden.
Stand der Forschung auf Hypophysen-Erkrankungen wurde vor allem unter Verwendung von Tiermodellen, wie z.B. knock out-Mäuse. Aber manchmal gibt es Unterschiede in den Phänotypen zwischen Tier und Mensch. Dies bedeutet, dass die menschlichen Modelle sind notwendig, um vollständig zu verstehen, die Mechanismen von Krankheiten.
In den letzten Jahren, iPS (induzierte pluripotente Stammzellen) Zellen genutzt wurden, in die Entwicklung von krankheitsmodellen, die regenerative Medizin und Pharmaforschung. Zusätzlich wird ein Verfahren mit iPS-Zellen zu induzieren Differenzierung sowohl der Hypophyse und des hypothalamus in-vitro – entwickelt wurde; aber es hatte noch nicht angewendet werden-Hypophysen-Krankheit-Modellierung.
Mit diesem im Verstand, Forscher an der Universität Kobe Graduate School of Medicine beworben haben, diese Strategie zu entwickeln, die ein menschliches Modell der CPH in-vitro – Verwendung von iPS-Zellen zu verstehen, die Pathophysiologie und die Ursachen der Krankheit.
Forschungs-Methodik
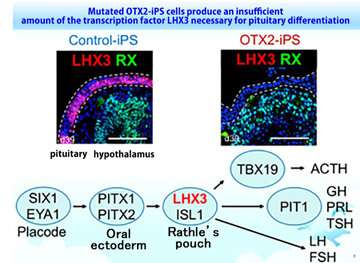
iPS-Zellen generiert wurden, aus Blutproben von Patienten mit CPH. Diese Patienten zeigten angeborene Hypoplasie der Hypophyse und nehme Hypophyse Hormon-Ersatz-Therapie. Diese Patienten abgeleiteten iPS-Zellen verwendet wurden, die zur Aufklärung der zugrunde liegenden Mechanismen in vitro. Interessanterweise ist die Steuerung der iPS-Zellen differenzierten in Hormon-produzierenden Zellen; aber der CPH-Patienten abgeleiteten iPS-Zellen waren nicht in der Lage, die Differenzierung zu diesen Zellen. Die weitere Analyse der Differenzierung Prozess ergab, dass der Transkriptionsfaktor LHX3, die unerlässlich für die Hypophyse Differenzierung, nicht zum Ausdruck in der Hypophyse Progenitorzellen von Patienten abgeleiteten iPS-Zellen. Exom-Sequenzierung Analyse zeigte, dass eine mutation in der OTX2-gen und seine Funktion beeinträchtigt wurde. Korrektur der OTX2-mutation in Patienten-abgeleiteten iPS-Zellen wieder die Hypophyse Differenzierung Fähigkeit, die belegen, dass die OTX2-mutation verantwortlich war.
Wechselwirkungen zwischen der Hypophyse und der angrenzenden hypothalamus sind essentiell für Hypophysen-Differenzierung und-Regulierung. Ein Vorteil dieses Modells ist, dass es gleichzeitig entwickeln die Hypophyse und hypothalamus , die in vitro aus iPS-Zellen. Dies erlaubt den Forschern, zu untersuchen, die Bedeutung der Interaktion zwischen diesen Geweben. Sie verdeutlicht, dass der hypothalamus für die Erkrankung verantwortlich ist, durch ausführen Chimäre Bildung Experimente mit den Patienten abgeleiteten iPS-Zellen und gesunde iPS-Zellen. Nachfolgende Analysen zeigten, dass FGF-10 (fibroblast growth factor 10) aus dem hypothalamus spielt eine zentrale Rolle in der expression von dem Transkriptionsfaktor LHX3 in der Hypophyse. Darüber hinaus expression von LHX3 die wiederhergestellt wurden durch Zugabe von FGF-10 in vitro. Diese Ergebnisse demonstrieren, dass FGF-10-Mangel in den hypothalamus im Zusammenhang mit OTX2-mutation verantwortlich war.
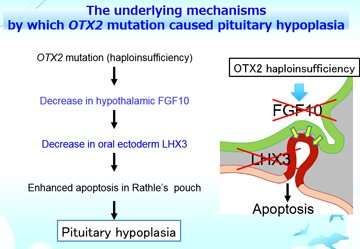
Kollektiv, das OTX2-mutation verursacht eine Verringerung im Hypothalamus FGF-10, die zu einem Mangel des LHX3-expression in der oralen Ektoderm, das ist der Vorläufer der Hypophyse. Folglich, Verlust von LHX3 verursacht Apoptose der Vorläuferzellen, wodurch die gestörte Entwicklung der Hypophyse. Die zugrunde liegenden Mechanismen beleuchtet zum ersten mal von dieser Studie.
Diese Hypophysen-Krankheit Modell unter Verwendung menschlichen iPS-Zellen hat, erläutert der ausführliche zugrunde liegenden Mechanismen, die Tier-Modelle waren nicht in der Lage, Sie zu zeigen.
Weitere Forschung
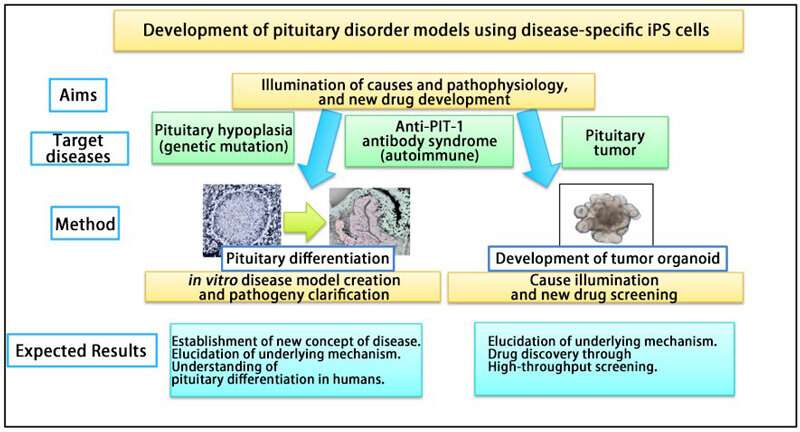
Diese Untersuchungen ergaben die Pathophysiologie des CPH durch Krankheits-spezifischen iPS-Zellen. Darüber hinaus wurde das Modell auch nützlich für das Verständnis der Hypophyse Differenzierung Prozess im Menschen.
Das Forscherteam auch untersuchen die Ursachen, Pathogenese und Behandlung von anderen Hypophysen-Erkrankungen (z.B. Autoimmun-Erkrankungen und Hypophysen-Tumoren) mit der gleichen Strategie. Insbesondere, Sie weiter zu entwickeln-Hypophysen-Krankheit-Modelle zur Untersuchung der Pathophysiologie und die genauen Mechanismen, die der ‚Anti-PIT-1-Antikörper-Syndrom“, das ist eine neue Art von Autoimmun-Hypophysen-Erkrankung, die das team gegründet hat, wie eine neue klinische Entität. Mit diesem Modell haben Sie bereits gezeigt, die antigen-Präsentation von PIT-1-protein-Epitop auf die Hypophysäre Zellen von Patienten der iPS-Zellen.
